Ketika kita berbicara tentang kesetimbangan kimia, ada banyak faktor yang dapat mempengaruhinya. Salah satu faktor yang paling signifikan adalah perubahan konsentrasi reaktan atau produk. Mari kita eksplorasi bagaimana perubahan konsentrasi dapat mempengaruhi kesetimbangan kimia dan implikasinya dalam berbagai aplikasi.
Pendahuluan
Kesetimbangan kimia adalah kondisi di mana laju reaksi maju sama dengan laju reaksi balik dalam sistem tertutup. Dalam keadaan ini, konsentrasi reaktan dan produk tetap konstan seiring waktu. Namun, kesetimbangan ini bersifat dinamis dan dapat dipengaruhi oleh berbagai faktor eksternal, termasuk perubahan konsentrasi.
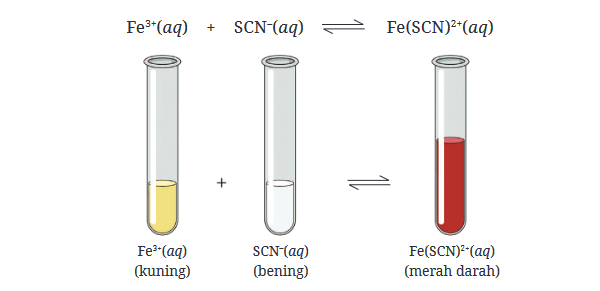
Bab 1: Prinsip Le Chatelier dan Perubahan Konsentrasi
Prinsip Le Chatelier, yang dikemukakan oleh ahli kimia Prancis Henry Louis Le Chatelier pada tahun 1884, menyatakan bahwa jika suatu sistem dalam kesetimbangan mengalami gangguan, sistem tersebut akan menyesuaikan diri untuk mengurangi efek gangguan tersebut. Prinsip ini sangat penting dalam memahami bagaimana perubahan konsentrasi mempengaruhi kesetimbangan kimia.
Ketika konsentrasi salah satu komponen dalam sistem kesetimbangan diubah, sistem akan bereaksi dengan cara yang meminimalkan perubahan tersebut. Misalnya, jika konsentrasi reaktan ditingkatkan, kesetimbangan akan bergeser ke arah produk untuk mengkompensasi peningkatan tersebut. Sebaliknya, jika konsentrasi produk ditingkatkan, kesetimbangan akan bergeser ke arah reaktan.
Bab 2: Efek Perubahan Konsentrasi pada Konstanta Kesetimbangan
Salah satu aspek penting yang perlu dipertimbangkan adalah pengaruh perubahan konsentrasi terhadap konstanta kesetimbangan (Kc). Konstanta kesetimbangan adalah rasio konsentrasi produk terhadap reaktan pada keadaan setimbang, dan nilainya tetap pada suhu tertentu.
Meskipun perubahan konsentrasi dapat menggeser kesetimbangan, hal ini tidak mempengaruhi nilai Kc. Ini karena sistem akan menyesuaikan diri untuk mempertahankan rasio konsentrasi yang sama pada keadaan setimbang yang baru. Pemahaman ini sangat penting dalam memprediksi perilaku sistem kimia dalam berbagai kondisi.
Bab 3: Aplikasi Praktis Pengaruh Perubahan Konsentrasi
Pemahaman tentang pengaruh perubahan konsentrasi pada kesetimbangan kimia memiliki banyak aplikasi praktis dalam industri dan kehidupan sehari-hari. Salah satu contoh yang paling relevan adalah dalam proses Haber untuk produksi amonia, yang merupakan bahan baku penting dalam industri pupuk.
Dalam proses Haber, nitrogen dan hidrogen bereaksi untuk menghasilkan amonia:
N2 + 3H2 ⇌ 2NH3
Dengan memanipulasi konsentrasi reaktan (nitrogen dan hidrogen) atau menghilangkan produk (amonia) secara kontinyu, produsen dapat menggeser kesetimbangan untuk meningkatkan hasil amonia. Ini menunjukkan bagaimana pemahaman tentang pengaruh konsentrasi pada kesetimbangan dapat digunakan untuk mengoptimalkan proses industri.
Bab 4: Tantangan dan Pertimbangan dalam Mengelola Kesetimbangan Kimia
Meskipun prinsip-prinsip yang mengatur pengaruh perubahan konsentrasi pada kesetimbangan kimia relatif sederhana, penerapannya dalam sistem yang kompleks dapat menjadi sangat menantang. Dalam banyak reaksi industri, misalnya, ada banyak kesetimbangan yang saling terkait yang harus dipertimbangkan secara simultan.
Selain itu, faktor-faktor lain seperti suhu, tekanan, dan kehadiran katalis juga dapat mempengaruhi kesetimbangan, sering kali berinteraksi dengan efek perubahan konsentrasi dengan cara yang kompleks. Oleh karena itu, para ilmuwan dan insinyur kimia harus mempertimbangkan berbagai faktor ini secara holistik ketika merancang dan mengoptimalkan proses kimia.
Keuntungan Memahami Pengaruh Konsentrasi pada Kesetimbangan:
- Optimalisasi proses industri
- Peningkatan efisiensi reaksi kimia
- Kontrol yang lebih baik atas hasil reaksi
Langkah-langkah untuk Menganalisis Pengaruh Konsentrasi pada Kesetimbangan:
- Identifikasi sistem kesetimbangan
- Tentukan arah pergeseran kesetimbangan berdasarkan perubahan konsentrasi
- Hitung konsentrasi baru pada keadaan setimbang
- Verifikasi bahwa konstanta kesetimbangan tetap tidak berubah
Fitur Kunci dalam Studi Kesetimbangan Kimia:
- Pendekatan kuantitatif menggunakan konstanta kesetimbangan
- Aplikasi prinsip Le Chatelier
- Analisis grafik dan matematis perubahan konsentrasi
FAQ
Apa itu kesetimbangan kimia?
Kesetimbangan kimia adalah kondisi di mana laju reaksi maju sama dengan laju reaksi balik dalam sistem tertutup, sehingga konsentrasi reaktan dan produk tetap konstan seiring waktu.
Bagaimana perubahan konsentrasi mempengaruhi kesetimbangan?
Perubahan konsentrasi akan menggeser kesetimbangan sesuai dengan prinsip Le Chatelier. Jika konsentrasi reaktan ditingkatkan, kesetimbangan akan bergeser ke arah produk, dan sebaliknya.
Apakah perubahan konsentrasi mempengaruhi konstanta kesetimbangan?
Tidak, perubahan konsentrasi tidak mempengaruhi nilai konstanta kesetimbangan (Kc). Kc hanya berubah dengan perubahan suhu.
Bagaimana prinsip ini diterapkan dalam industri?
Prinsip ini diterapkan dalam berbagai proses industri, seperti produksi amonia dalam proses Haber, di mana konsentrasi reaktan dan produk dimanipulasi untuk mengoptimalkan hasil.
Apa tantangan dalam mengelola kesetimbangan kimia?
Tantangan utama termasuk mengelola sistem dengan banyak kesetimbangan yang saling terkait dan mempertimbangkan interaksi antara berbagai faktor yang mempengaruhi kesetimbangan, seperti suhu, tekanan, dan kehadiran katalis.
Pemahaman yang mendalam tentang pengaruh perubahan konsentrasi pada kesetimbangan kimia sangat penting dalam berbagai bidang, mulai dari penelitian ilmiah dasar hingga aplikasi industri skala besar. Dengan menguasai prinsip-prinsip ini, kita dapat lebih baik dalam mengendalikan dan mengoptimalkan reaksi kimia, membuka jalan bagi inovasi dan efisiensi yang lebih besar dalam produksi bahan kimia dan material penting.
Referensi:
- Atkins, P. W., & de Paula, J. (2014). Atkins’ Physical Chemistry (10th ed.). Oxford University Press.
- Chang, R., & Goldsby, K. A. (2015). Chemistry (12th ed.). McGraw-Hill Education.
- Le Chatelier, H. L. (1884). Sur un énoncé général des lois des équilibres chimiques. Comptes Rendus, 99, 786-789.
- Silberberg, M. S., & Amateis, P. (2018). Chemistry: The Molecular Nature of Matter and Change (8th ed.). McGraw-Hill Education.
- Smith, J. M., Van Ness, H. C., & Abbott, M. M. (2017). Introduction to Chemical Engineering Thermodynamics (8th ed.). McGraw-Hill Education.