Dalam kimia organik, terdapat berbagai jenis reaksi kimia yang berperan penting dalam membentuk, mengubah, dan membongkar molekul. Salah satu reaksi yang paling penting dan sering dijumpai adalah reaksi substitusi. Reaksi substitusi merupakan proses kimia di mana atom atau gugus atom dalam suatu molekul digantikan oleh atom atau gugus atom lain. Reaksi ini banyak digunakan dalam sintesis kimia dan biologi untuk membentuk berbagai senyawa organik dan anorganik. Reaksi substitusi ditemukan dalam banyak reaksi kimia, mulai dari pembuatan obat-obatan hingga bahan-bahan kimia dasar yang digunakan dalam industri.

Artikel ini akan membahas secara rinci tentang reaksi substitusi, termasuk mekanisme, jenis-jenisnya, serta contoh-contoh umum yang ditemukan dalam berbagai bidang kimia.
Pengertian Reaksi Substitusi
Reaksi substitusi adalah reaksi kimia di mana suatu atom atau gugus atom pada molekul ditukar dengan atom atau gugus atom lain. Dalam konteks senyawa organik, reaksi ini biasanya melibatkan molekul yang mengandung ikatan karbon-hidrogen atau karbon-karbon, di mana satu atom atau gugus atom digantikan oleh atom lain yang berbeda. Reaksi substitusi dapat terjadi pada berbagai jenis senyawa organik, termasuk alkana, alkena, alkuna, aromatik, dan senyawa heterosiklik.
Dalam reaksi substitusi, biasanya terdapat dua komponen utama yang berperan:
- Substrat: Molekul yang mengalami substitusi, yaitu molekul yang mengandung atom atau gugus atom yang akan digantikan.
- Reagen: Molekul atau ion yang akan menggantikan atom atau gugus atom pada substrat.
Reaksi substitusi tidak hanya terbatas pada senyawa organik, tetapi juga terjadi dalam senyawa anorganik, meskipun dalam konteks organik, reaksi ini lebih sering dibahas karena perannya yang sangat besar dalam sintesis molekul kompleks.
Jenis-Jenis Reaksi Substitusi
Terdapat dua jenis utama reaksi substitusi dalam kimia organik, yaitu substitusi nukleofilik dan substitusi elektrofilik. Keduanya dibedakan berdasarkan jenis reagen yang menyerang substrat, apakah itu nukleofil atau elektrofil.
1. Substitusi Nukleofilik
Substitusi nukleofilik adalah reaksi di mana gugus yang meninggalkan substrat digantikan oleh nukleofil, yaitu suatu spesies yang memiliki pasangan elektron bebas yang dapat digunakan untuk menyerang pusat yang kekurangan elektron pada substrat. Reaksi ini umumnya terjadi pada senyawa alkil halida, di mana halogen bertindak sebagai gugus yang meninggalkan, dan nukleofil menyerang pusat karbon yang terikat pada halogen tersebut.
Mekanisme reaksi substitusi nukleofilik dapat dibagi menjadi dua mekanisme utama, yaitu SN1 dan SN2:
- Mekanisme SN1 (Substitusi Nukleofilik Unimolekuler): Reaksi ini terjadi dalam dua langkah. Pada langkah pertama, gugus yang meninggalkan (seperti halogen) lepas dari substrat, membentuk ion karbokation yang bersifat sangat reaktif. Pada langkah kedua, nukleofil menyerang karbokation tersebut, menggantikan gugus yang telah meninggalkan. Mekanisme SN1 sering terjadi pada substrat yang dapat membentuk karbokation yang stabil, seperti senyawa alkil tersier.
- Mekanisme SN2 (Substitusi Nukleofilik Bimolekuler): Pada mekanisme ini, reaksi terjadi dalam satu langkah, di mana nukleofil menyerang pusat karbon yang terikat pada gugus yang meninggalkan secara simultan. Pada saat yang sama, gugus yang meninggalkan terlepas dari substrat. Mekanisme ini disebut bimolekuler karena melibatkan interaksi langsung antara nukleofil dan substrat dalam satu langkah. Mekanisme SN2 lebih umum terjadi pada senyawa alkil primer atau sekunder, di mana tidak ada penghalang sterik yang signifikan untuk menyerang pusat karbon.
Contoh Substitusi Nukleofilik: Salah satu contoh klasik dari reaksi substitusi nukleofilik adalah reaksi antara natrium hidroksida (NaOH) dengan kloroetana (C₂H₅Cl), di mana ion hidroksida (OH⁻) bertindak sebagai nukleofil yang menggantikan atom klorida pada kloroetana untuk membentuk etanol (C₂H₅OH).
Reaksinya dapat ditulis sebagai berikut:
- C₂H₅Cl + NaOH → C₂H₅OH + NaCl
Dalam reaksi ini, gugus halogen (Cl) digantikan oleh nukleofil (OH⁻), dan produk akhir adalah etanol.
2. Substitusi Elektrofilik
Substitusi elektrofilik adalah reaksi di mana gugus yang meninggalkan substrat digantikan oleh elektrofil, yaitu suatu spesies yang kekurangan elektron dan tertarik pada elektron yang tersedia pada substrat. Reaksi ini umum terjadi pada senyawa aromatik, seperti benzena, karena cincin aromatik memiliki elektron π yang membuatnya kaya elektron dan menarik bagi elektrofil.
Mekanisme reaksi substitusi elektrofilik umumnya melibatkan pembentukan intermediat karbokation, di mana cincin aromatik kehilangan stabilitas sementara saat berikatan dengan elektrofil, sebelum melepaskan proton untuk mengembalikan struktur aromatik yang stabil.
Contoh yang paling terkenal dari reaksi substitusi elektrofilik adalah nitrasi benzena, di mana benzena bereaksi dengan asam nitrat (HNO₃) dalam kehadiran asam sulfat (H₂SO₄) untuk menghasilkan nitrobenzena.
Reaksi ini dapat dituliskan sebagai:
- C₆H₆ + HNO₃ → C₆H₅NO₂ + H₂O
Dalam reaksi ini, gugus nitro (-NO₂) dari asam nitrat menggantikan satu atom hidrogen pada cincin benzena, menghasilkan nitrobenzena.
3. Substitusi Radikal Bebas
Selain substitusi nukleofilik dan elektrofilik, terdapat juga reaksi substitusi radikal bebas, yang melibatkan radikal bebas sebagai reagen. Radikal bebas adalah atom atau molekul yang memiliki elektron tidak berpasangan dan sangat reaktif.
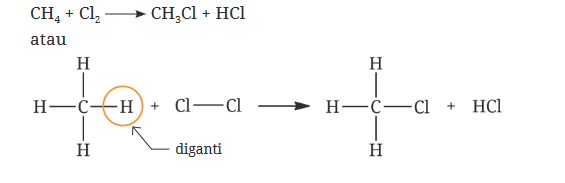
Reaksi substitusi radikal bebas umumnya terjadi pada alkana. Salah satu contoh paling umum dari reaksi ini adalah halogenasi alkana, di mana atom hidrogen pada alkana digantikan oleh atom halogen melalui mekanisme radikal bebas. Contoh klasik dari halogenasi radikal bebas adalah klorinasi metana (CH₄), di mana metana bereaksi dengan klor (Cl₂) untuk menghasilkan klorometana (CH₃Cl) dan hidrogen klorida (HCl).
Reaksi ini berlangsung melalui tiga tahap:
- Inisiasi: Molekul Cl₂ dipecah oleh energi (seperti cahaya) untuk menghasilkan dua radikal bebas Cl.
- Propagasi: Radikal bebas Cl menyerang metana, menghilangkan satu atom hidrogen dan membentuk radikal metil (CH₃•).
- Terminasi: Dua radikal bebas bertemu dan membentuk molekul stabil, menghentikan rantai reaksi.
Reaksi klorinasi metana dapat dituliskan sebagai:
- CH₄ + Cl₂ → CH₃Cl + HCl
Faktor-Faktor yang Mempengaruhi Reaksi Substitusi
Ada beberapa faktor yang memengaruhi jalannya reaksi substitusi, baik itu reaksi nukleofilik, elektrofilik, atau radikal bebas. Beberapa faktor penting tersebut adalah:
- Sifat Substrat: Dalam reaksi substitusi nukleofilik, substrat yang lebih rentan terhadap serangan nukleofil biasanya memiliki gugus yang meninggalkan lebih baik dan lebih sedikit penghalang sterik. Misalnya, alkil primer lebih reaktif terhadap mekanisme SN2 dibandingkan alkil tersier.
- Jenis Gugus yang Meninggalkan: Gugus yang meninggalkan yang lebih stabil setelah terlepas dari substrat cenderung mempercepat reaksi substitusi. Gugus yang meninggalkan yang baik, seperti halida (Cl⁻, Br⁻), biasanya meningkatkan laju reaksi.
- Kekuatan Nukleofil atau Elektrofil: Dalam substitusi nukleofilik, nukleofil yang lebih kuat, seperti ion hidroksida (OH⁻), akan lebih reaktif dibandingkan nukleofil yang lebih lemah, seperti air (H₂O). Dalam substitusi elektrofilik, elektrofil yang lebih kuat akan lebih mudah menyerang substrat yang kaya elektron.
- Pelarut: Pelarut juga memainkan peran penting dalam reaksi substitusi. Pelarut polar protik (seperti air dan etanol) cenderung mendukung mekanisme SN1 karena stabilisasi karbokation, sementara pelarut polar aprotik (seperti asetonitril) mendukung mekanisme SN2 dengan menstabilkan nukleofil.
- Suhu: Suhu juga dapat memengaruhi laju reaksi. Reaksi substitusi yang melibatkan radikal bebas, seperti halogenasi alkana, sering kali memerlukan suhu tinggi atau energi dari cahaya untuk memulai pemecahan molekul halogen menjadi radikal bebas.
Aplikasi Reaksi Substitusi
Reaksi substitusi memainkan peran penting dalam berbagai bidang, termasuk sintesis kimia, industri farmasi, dan penelitian biologi. Beberapa aplikasi reaksi substitusi meliputi:
- Sintesis obat-obatan: Banyak obat-obatan disintesis melalui reaksi substitusi, di mana gugus fungsional spesifik ditambahkan ke senyawa dasar untuk meningkatkan aktivitas biologisnya.
- Pembuatan bahan kimia: Reaksi substitusi juga digunakan dalam industri untuk memproduksi bahan kimia seperti plastik, pelarut, dan bahan pewarna. Contoh: sintesis polivinil klorida (PVC) menggunakan reaksi substitusi radikal bebas.
- Rekayasa enzim: Dalam biologi, enzim bekerja melalui mekanisme substitusi di mana substrat enzim digantikan oleh produk reaksi, yang penting dalam metabolisme dan biosintesis dalam tubuh makhluk hidup.
Kesimpulan
Reaksi substitusi adalah salah satu reaksi kimia fundamental di mana suatu atom atau gugus atom dalam molekul digantikan oleh atom atau gugus atom lain. Reaksi ini dapat terjadi melalui mekanisme nukleofilik, elektrofilik, atau radikal bebas, tergantung pada jenis reagen yang menyerang substrat. Reaksi substitusi memainkan peran penting dalam berbagai aplikasi kimia, dari sintesis organik hingga pengembangan obat dan industri kimia. Pemahaman yang mendalam tentang jenis-jenis dan mekanisme reaksi substitusi memungkinkan kita untuk merancang reaksi yang lebih efisien dan selektif dalam berbagai konteks ilmiah dan industri.