Afinitas elektron adalah salah satu konsep penting dalam bidang kimia yang berkaitan dengan sifat atom atau molekul dalam menerima elektron. Konsep ini membantu menjelaskan bagaimana atom berinteraksi satu sama lain, khususnya dalam pembentukan ikatan kimia. Dalam konteks kimia, afinitas elektron merujuk pada jumlah energi yang dilepaskan atau diserap ketika sebuah atom netral dalam keadaan gas menerima sebuah elektron untuk membentuk ion negatif.

Sebagai salah satu sifat kimia atom, afinitas elektron berperan penting dalam menentukan reaktivitas unsur-unsur, terutama dalam pembentukan senyawa ionik dan sifat dasar kimia suatu elemen. Artikel ini akan membahas lebih lanjut mengenai definisi afinitas elektron, faktor-faktor yang mempengaruhinya, pola periodik, dan penerapannya dalam ilmu kimia.
Definisi Afinitas Elektron
Afinitas elektron secara sederhana didefinisikan sebagai energi yang dilepaskan ketika sebuah atom netral dalam keadaan gas menangkap atau menerima sebuah elektron untuk membentuk ion bermuatan negatif (anion). Ini dapat digambarkan dalam reaksi berikut:
A(g) + e⁻ → A⁻(g)
Pada reaksi tersebut, sebuah atom A dalam fase gas menangkap sebuah elektron (e⁻) dan berubah menjadi ion A⁻ yang bermuatan negatif. Energi yang dilepaskan dalam proses ini dikenal sebagai afinitas elektron. Jika energi dilepaskan, maka afinitas elektron memiliki nilai negatif, karena penambahan elektron pada atom merupakan proses yang cenderung stabil dan energi dilepaskan dalam bentuk panas.
Sebaliknya, jika energi harus diserap oleh atom untuk menangkap elektron, afinitas elektron akan bernilai positif. Ini berarti bahwa atom tersebut memiliki kecenderungan yang rendah untuk menangkap elektron, atau proses penambahan elektron pada atom tersebut memerlukan energi tambahan.
Afinitas elektron pertama (proses penambahan elektron pertama kali pada atom) umumnya menghasilkan pelepasan energi. Namun, afinitas elektron kedua (penambahan elektron kedua pada ion yang sudah bermuatan negatif) seringkali membutuhkan energi tambahan karena gaya tolak antara elektron baru dan ion negatif yang sudah terbentuk.
Mekanisme Penangkapan Elektron
Ketika sebuah atom menerima sebuah elektron, ada dua faktor utama yang berperan dalam proses ini:
- Gaya tarik elektrostatik antara elektron tambahan dengan inti atom yang bermuatan positif. Inti atom yang terdiri dari proton akan menarik elektron baru dan menstabilkan sistem.
- Repulsi elektron antara elektron yang sudah ada di atom dengan elektron baru yang masuk. Repulsi ini terjadi karena muatan negatif dari elektron saling menolak.
Afinitas elektron dipengaruhi oleh keseimbangan antara gaya tarik inti dan repulsi antar elektron. Pada atom-atom yang memiliki inti yang sangat kuat dan jarak yang relatif dekat antara inti dan elektron, afinitas elektron cenderung lebih besar karena elektron baru dapat ditangkap lebih mudah. Sebaliknya, pada atom yang memiliki banyak kulit elektron atau elektron valensi yang terletak jauh dari inti, gaya tarik inti terhadap elektron baru lebih lemah, sehingga afinitas elektronnya lebih rendah.
Faktor-faktor yang Mempengaruhi Afinitas Elektron
Afinitas elektron sangat dipengaruhi oleh beberapa faktor penting yang terkait dengan struktur atom, antara lain:
1. Ukuran Atom
Ukuran atom memainkan peran besar dalam menentukan afinitas elektron. Pada atom yang lebih kecil, elektron tambahan dapat ditangkap lebih dekat ke inti atom. Gaya tarik elektrostatik yang lebih besar antara elektron baru dan inti menyebabkan afinitas elektron lebih besar. Misalnya, unsur-unsur non-logam di periode kedua, seperti fluor dan oksigen, memiliki afinitas elektron yang tinggi karena ukuran atom mereka relatif kecil.
Sebaliknya, pada atom yang lebih besar, elektron tambahan terletak lebih jauh dari inti, sehingga gaya tarik elektrostatik antara inti dan elektron lebih lemah. Hal ini menyebabkan afinitas elektron pada atom yang lebih besar cenderung lebih kecil. Misalnya, unsur-unsur seperti kalium dan rubidium, yang memiliki ukuran atom besar, memiliki afinitas elektron yang rendah.
2. Konfigurasi Elektron
Konfigurasi elektron dari sebuah atom juga sangat mempengaruhi afinitas elektron. Unsur-unsur yang hampir mencapai konfigurasi oktet (delapan elektron di kulit terluar) cenderung memiliki afinitas elektron yang tinggi, karena menangkap satu elektron tambahan akan membuat atom tersebut mencapai stabilitas maksimum.
Sebagai contoh, unsur-unsur golongan halogen seperti fluor, klor, dan brom memiliki afinitas elektron yang sangat tinggi. Hal ini karena mereka hanya membutuhkan satu elektron lagi untuk melengkapi konfigurasi oktetnya, sehingga proses penangkapan elektron menjadi sangat stabil.
Sebaliknya, unsur-unsur yang sudah memiliki konfigurasi elektron yang stabil, seperti gas mulia, cenderung memiliki afinitas elektron yang sangat rendah, atau bahkan positif. Gas mulia memiliki kulit terluar yang penuh (konfigurasi oktet), sehingga mereka tidak cenderung menangkap elektron baru, karena hal ini akan mengganggu kestabilan mereka.
3. Muatan Inti Efektif
Muatan inti efektif adalah ukuran seberapa kuat inti atom menarik elektron yang terletak di sekitarnya. Jika muatan inti efektif tinggi, afinitas elektron juga cenderung tinggi, karena elektron baru akan lebih mudah ditarik oleh inti atom. Sebaliknya, jika muatan inti efektif rendah, elektron baru akan lebih sulit ditangkap oleh atom.
Muatan inti efektif dipengaruhi oleh jumlah proton dalam inti atom serta jarak antara inti dengan elektron yang ditambahkan. Oleh karena itu, unsur-unsur di bagian kanan tabel periodik (yang memiliki jumlah proton lebih banyak dan jarak inti ke elektron lebih dekat) cenderung memiliki afinitas elektron yang lebih tinggi dibandingkan dengan unsur-unsur di bagian kiri.
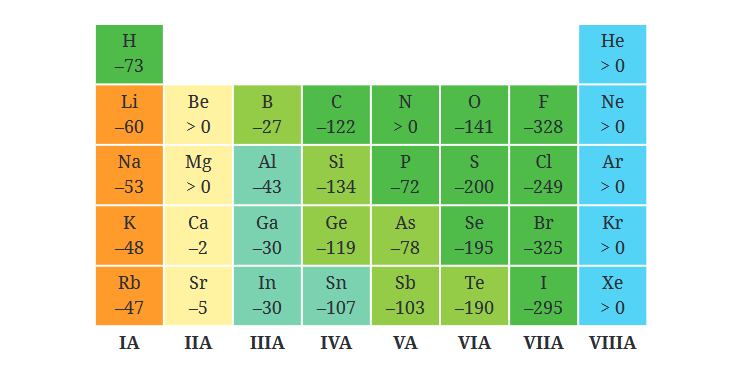
Pola Periodik Afinitas Elektron
Afinitas elektron mengikuti pola tertentu di sepanjang tabel periodik, yang memudahkan kita dalam memprediksi nilai afinitas elektron dari suatu unsur.
- Dalam satu periode (baris horizontal), afinitas elektron umumnya meningkat dari kiri ke kanan. Ini disebabkan oleh peningkatan jumlah proton di dalam inti atom, yang meningkatkan muatan inti efektif dan membuat atom-atom lebih cenderung menangkap elektron untuk mencapai konfigurasi stabil. Contoh utamanya adalah unsur-unsur golongan halogen seperti klor dan fluor, yang memiliki afinitas elektron sangat tinggi karena mereka hanya membutuhkan satu elektron lagi untuk mencapai konfigurasi oktet.
- Dalam satu golongan (kolom vertikal), afinitas elektron cenderung menurun dari atas ke bawah. Ini terjadi karena ukuran atom semakin besar seiring bertambahnya jumlah kulit elektron, sehingga elektron tambahan ditempatkan lebih jauh dari inti atom. Dengan jarak yang lebih jauh, gaya tarik elektrostatik antara inti dan elektron baru melemah, yang mengakibatkan afinitas elektron lebih rendah. Misalnya, fluor (di bagian atas golongan halogen) memiliki afinitas elektron yang lebih tinggi daripada yodium (di bagian bawah golongan yang sama).
Namun, ada beberapa pengecualian terhadap pola ini. Misalnya, nitrogen memiliki afinitas elektron yang lebih rendah dibandingkan dengan oksigen, meskipun letaknya berada di sebelah kanan oksigen di tabel periodik. Hal ini disebabkan oleh konfigurasi elektron nitrogen yang setengah penuh (tiga elektron di orbital p), yang memberikan kestabilan relatif sehingga nitrogen kurang cenderung menangkap elektron baru.
Afinitas Elektron Negatif dan Positif
Sebagian besar unsur memiliki afinitas elektron negatif, yang berarti bahwa energi dilepaskan ketika elektron ditambahkan ke atom. Ini menunjukkan bahwa atom cenderung menangkap elektron dan menjadi lebih stabil dalam prosesnya. Contohnya adalah klor, yang melepaskan energi yang signifikan ketika menerima satu elektron untuk menjadi ion klorida (Cl⁻).
Namun, ada beberapa unsur yang memiliki afinitas elektron positif, artinya energi harus diserap agar atom dapat menangkap elektron. Ini terjadi pada unsur-unsur seperti gas mulia (helium, neon, argon, dan lain-lain), di mana konfigurasi elektron yang sudah penuh menyebabkan penambahan elektron baru menjadi proses yang tidak menguntungkan. Oleh karena itu, unsur-unsur ini memiliki afinitas elektron yang positif, yang menunjukkan bahwa mereka sangat tidak cenderung menangkap elektron baru.
Peran Afinitas Elektron dalam Pembentukan Ikatan
Afinitas elektron sangat penting dalam pembentukan senyawa ionik, di mana atom-atom dengan afinitas elektron tinggi (seperti halogen) cenderung menerima elektron dari atom-atom dengan energi ionisasi rendah (seperti logam alkali). Misalnya, natrium (Na) memiliki kecenderungan untuk melepaskan satu elektron, sementara klor (Cl) memiliki afinitas elektron yang tinggi untuk menangkap elektron tersebut. Ketika ini terjadi, natrium membentuk ion positif (Na⁺), dan klor membentuk ion negatif (Cl⁻), yang kemudian berikatan membentuk senyawa ionik natrium klorida (NaCl).
Selain itu, afinitas elektron juga memainkan peran dalam menentukan sifat elektronegativitas suatu unsur, yang mempengaruhi cara unsur-unsur berinteraksi dalam senyawa kovalen. Unsur dengan afinitas elektron tinggi cenderung memiliki elektronegativitas yang tinggi, yang berarti bahwa mereka lebih cenderung menarik elektron ke arah mereka dalam ikatan kovalen.
Penerapan Afinitas Elektron dalam Teknologi
Dalam teknologi modern, pemahaman tentang afinitas elektron menjadi penting dalam berbagai aplikasi, seperti dalam desain baterai, material semikonduktor, dan katalis. Sebagai contoh, pada sel surya dan perangkat elektronik, afinitas elektron memengaruhi bagaimana elektron ditransfer di antara bahan-bahan yang berbeda, mempengaruhi efisiensi konduksi listrik dan produksi energi.
Selain itu, dalam proses pengolahan air limbah, bahan-bahan dengan afinitas elektron tinggi dapat digunakan untuk mengikat dan menetralkan ion logam berat yang beracun.
Kesimpulan
Afinitas elektron adalah konsep penting dalam kimia yang berkaitan dengan kecenderungan atom untuk menangkap elektron. Ini memainkan peran penting dalam pembentukan ikatan kimia, terutama dalam senyawa ionik, serta dalam menentukan reaktivitas unsur. Faktor-faktor seperti ukuran atom, konfigurasi elektron, dan muatan inti efektif sangat memengaruhi nilai afinitas elektron suatu unsur. Dengan memahami afinitas elektron, kita dapat memprediksi perilaku kimia unsur-unsur dalam tabel periodik serta aplikasinya dalam teknologi dan proses kimia sehari-hari.