Ketika kita berbicara tentang energi ionisasi, kita memasuki dunia yang menarik di mana fisika dan kimia berinteraksi untuk mengungkap sifat-sifat dasar materi. Mari kita jelajahi konsep penting ini dan implikasinya dalam ilmu pengetahuan modern.
Pendahuluan
Energi ionisasi adalah konsep fundamental dalam kimia fisika yang memiliki implikasi luas dalam berbagai bidang, mulai dari astrofisika hingga teknologi material. Konsep ini menjelaskan seberapa kuat elektron terikat pada atom atau molekul, dan berapa banyak energi yang diperlukan untuk memisahkannya. Pemahaman yang mendalam tentang energi ionisasi sangat penting untuk menjelaskan berbagai fenomena alam dan merancang aplikasi teknologi baru.
Definisi dan Konsep Dasar Energi Ionisasi
Untuk memulai, mari kita jelajahi definisi dan konsep dasar energi ionisasi. Energi ionisasi didefinisikan sebagai jumlah energi minimum yang diperlukan untuk melepaskan elektron terluar dari atom atau ion dalam keadaan gas. Proses ini mengubah atom netral menjadi ion bermuatan positif.
Pemahaman tentang energi ionisasi sangat penting dalam kimia karena memberikan wawasan tentang reaktivitas kimia dan stabilitas atom atau molekul. Semakin tinggi energi ionisasi, semakin sulit untuk melepaskan elektron, yang berarti atom tersebut lebih stabil dan kurang reaktif.
Faktor-faktor yang Mempengaruhi Energi Ionisasi
Salah satu aspek penting yang perlu dipertimbangkan adalah faktor-faktor yang mempengaruhi energi ionisasi. Beberapa faktor utama meliputi:
- Ukuran atom: Secara umum, semakin besar ukuran atom, semakin rendah energi ionisasinya. Ini karena elektron terluar berada lebih jauh dari inti, sehingga gaya tarik elektrostatik antara inti dan elektron menjadi lebih lemah.
- Muatan inti efektif: Semakin besar muatan inti efektif, semakin kuat elektron terikat pada atom, sehingga energi ionisasi meningkat.
- Konfigurasi elektron: Atom dengan konfigurasi elektron yang stabil (seperti gas mulia) memiliki energi ionisasi yang lebih tinggi dibandingkan dengan atom yang memiliki elektron tidak berpasangan di kulit terluarnya.
- Efek perisai: Elektron pada kulit dalam dapat “melindungi” atau “memperisai” elektron terluar dari tarikan inti, yang dapat menurunkan energi ionisasi.
Memahami faktor-faktor ini penting untuk memprediksi dan menjelaskan tren energi ionisasi di seluruh tabel periodik.
Energi Ionisasi dalam Tabel Periodik
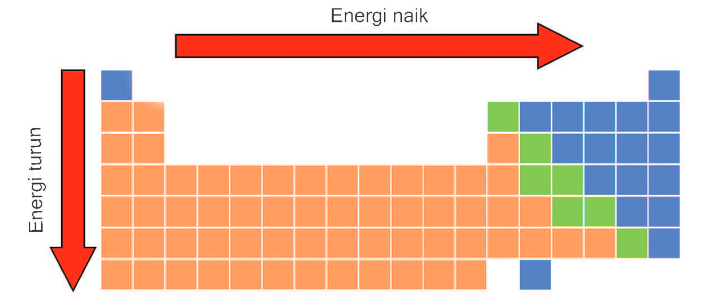
Sebuah area kritis yang perlu dieksplorasi adalah bagaimana energi ionisasi bervariasi di seluruh tabel periodik. Tren energi ionisasi dalam tabel periodik memberikan wawasan berharga tentang sifat-sifat unsur dan perilaku kimianya.
Secara umum, energi ionisasi meningkat dari kiri ke kanan dalam satu periode tabel periodik. Ini karena ketika kita bergerak dari kiri ke kanan, muatan inti efektif meningkat, menarik elektron lebih kuat. Namun, energi ionisasi umumnya menurun dari atas ke bawah dalam satu golongan. Ini disebabkan oleh peningkatan ukuran atom dan efek perisai yang lebih besar dari elektron dalam.
Pemahaman tentang tren ini sangat penting dalam memprediksi reaktivitas kimia dan stabilitas unsur-unsur.
Aplikasi dan Implikasi Energi Ionisasi
Ketika kita membahas tentang energi ionisasi, penting untuk memahami aplikasi dan implikasinya yang luas dalam berbagai bidang ilmu pengetahuan dan teknologi. Beberapa aplikasi penting meliputi:
- Spektroskopi: Energi ionisasi memainkan peran kunci dalam spektroskopi, membantu ilmuwan mengidentifikasi dan menganalisis unsur-unsur dalam bintang dan planet jauh.
- Desain Material: Pemahaman tentang energi ionisasi penting dalam merancang material baru dengan sifat-sifat khusus, seperti semikonduktor atau katalis.
- Kimia Atmosfer: Energi ionisasi membantu menjelaskan perilaku ion-ion dalam atmosfer bumi dan planet lain.
- Teknologi Baterai: Konsep energi ionisasi sangat relevan dalam pengembangan baterai ion-litium dan teknologi penyimpanan energi lainnya.
Memahami implikasi energi ionisasi dalam berbagai bidang ini membuka jalan bagi inovasi dan penemuan baru dalam sains dan teknologi.
Keuntungan memahami Energi Ionisasi:
- Pemahaman yang lebih baik tentang struktur atom
- Prediksi reaktivitas kimia yang lebih akurat
- Desain material yang lebih efisien
- Pengembangan teknologi baru
Langkah-langkah untuk mempelajari Energi Ionisasi:
- Pahami konsep dasar struktur atom
- Pelajari tren energi ionisasi dalam tabel periodik
- Analisis faktor-faktor yang mempengaruhi energi ionisasi
- Eksplorasi aplikasi praktis energi ionisasi
Fitur utama Energi Ionisasi:
- Ukuran kuantitatif kekuatan ikatan elektron
- Indikator reaktivitas kimia
- Variasi sistematis dalam tabel periodik
- Hubungan erat dengan sifat-sifat kimia lainnya
FAQ
Apa itu Energi Ionisasi?
Energi ionisasi adalah jumlah energi minimum yang diperlukan untuk melepaskan elektron terluar dari atom atau ion dalam keadaan gas, mengubahnya menjadi ion bermuatan positif.
Bagaimana Energi Ionisasi bekerja?
Energi ionisasi bekerja dengan memutuskan ikatan antara elektron terluar dan inti atom. Semakin kuat ikatan ini, semakin besar energi yang diperlukan untuk melepaskan elektron.
Apa manfaat memahami Energi Ionisasi?
Memahami energi ionisasi memberikan wawasan tentang reaktivitas kimia, stabilitas atom, dan sifat-sifat material. Ini penting dalam berbagai aplikasi, mulai dari desain material hingga astrofisika.
Apakah ada kerugian dalam mempelajari Energi Ionisasi?
Tidak ada kerugian signifikan dalam mempelajari energi ionisasi. Namun, konsep ini bisa menjadi kompleks dan membutuhkan pemahaman yang kuat tentang fisika dan kimia dasar.
Bagaimana cara memulai mempelajari Energi Ionisasi?
Untuk memulai mempelajari energi ionisasi, mulailah dengan memahami struktur atom dan tabel periodik. Kemudian, pelajari definisi energi ionisasi dan faktor-faktor yang mempengaruhinya. Terakhir, eksplorasi aplikasi praktisnya dalam berbagai bidang sains.
Referensi:
- Atkins, P., & de Paula, J. (2014). Atkins’ Physical Chemistry (10th ed.). Oxford University Press.
- Chang, R., & Goldsby, K. A. (2012). Chemistry (11th ed.). McGraw-Hill Education.
- Housecroft, C. E., & Sharpe, A. G. (2018). Inorganic Chemistry (5th ed.). Pearson.
- Miessler, G. L., Fischer, P. J., & Tarr, D. A. (2013). Inorganic Chemistry (5th ed.). Pearson.
- Zumdahl, S. S., & DeCoste, D. J. (2016). Chemistry (10th ed.). Cengage Learning.
Artikel ini memberikan pemahaman komprehensif tentang energi ionisasi, mulai dari konsep dasar hingga aplikasi praktisnya. Dengan memahami energi ionisasi, kita dapat lebih baik menjelaskan dan memprediksi perilaku kimia atom dan molekul, membuka jalan bagi penemuan dan inovasi baru dalam berbagai bidang ilmu pengetahuan dan teknologi.