Reaksi eliminasi merupakan salah satu jenis reaksi penting dalam kimia organik, di mana dua substituen yang terikat pada atom karbon dilepaskan (atau dieliminasi), membentuk ikatan rangkap, baik ikatan rangkap dua (alkena) atau ikatan rangkap tiga (alkuna). Reaksi eliminasi sering kali menjadi kebalikan dari reaksi adisi, yang melibatkan penambahan atom atau gugus atom ke ikatan rangkap. Proses eliminasi ini memainkan peran penting dalam sintesis organik, karena mampu mengubah senyawa jenuh menjadi senyawa tak jenuh yang lebih reaktif dan multifungsional.

Dalam reaksi eliminasi, atom atau gugus yang dilepaskan dapat berasal dari atom karbon yang sama atau dari atom karbon yang berdekatan. Ada beberapa jenis mekanisme eliminasi yang umum dikenal, seperti eliminasi E1, E2, dan eliminasi dalam kondisi yang lebih spesifik seperti eliminasi E1cB. Artikel ini akan membahas berbagai jenis reaksi eliminasi, mekanismenya, faktor-faktor yang mempengaruhinya, serta beberapa contoh dan aplikasinya dalam kimia organik.
Pengertian Reaksi Eliminasi
Secara sederhana, reaksi eliminasi adalah reaksi kimia di mana dua gugus atom atau molekul dihilangkan dari molekul induk, menghasilkan pembentukan ikatan rangkap. Reaksi ini sangat umum terjadi dalam senyawa organik yang mengandung gugus lepas yang baik, seperti halida alkil, alkohol, atau ester. Pada reaksi eliminasi, dua atom atau gugus, sering kali berupa hidrogen dan gugus halida, dilepaskan dari dua atom karbon yang berdekatan (atau terkadang dari atom karbon yang sama), dan ikatan rangkap terbentuk antara kedua atom karbon tersebut.
Contoh sederhana reaksi eliminasi:
- Eliminasi dehidrohalogenasi (penghilangan H dan X): Di sini, sebuah halida alkil, seperti bromoetana, akan mengalami eliminasi atom hidrogen dan bromin, menghasilkan etena (alkena).
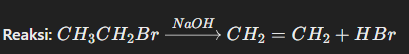 Dalam contoh ini, bromoetana (C₂H₅Br) mengalami eliminasi HBr, menghasilkan etena (C₂H₄) dengan ikatan rangkap dua antara kedua atom karbon.
Dalam contoh ini, bromoetana (C₂H₅Br) mengalami eliminasi HBr, menghasilkan etena (C₂H₄) dengan ikatan rangkap dua antara kedua atom karbon.
Jenis-jenis Reaksi Eliminasi
Ada beberapa jenis reaksi eliminasi yang bergantung pada mekanismenya. Tiga mekanisme utama yang sering dibahas dalam kimia organik adalah eliminasi E1, E2, dan E1cB. Setiap mekanisme memiliki perbedaan dalam hal langkah reaksi, kinetika, dan ketergantungannya pada substrat, basa, atau nukleofil.
1. Reaksi Eliminasi E2 (Eliminasi Bimolekuler)
Reaksi eliminasi E2 (eliminasi bimolekuler) adalah reaksi satu langkah yang berlangsung secara simultan. Dalam mekanisme E2, pelepasan gugus lepas (seperti halida) dan abstraksi proton oleh basa terjadi pada waktu yang sama. Reaksi ini disebut sebagai bimolekuler karena laju reaksi bergantung pada konsentrasi dua molekul, yaitu basa dan substrat.
Ciri-ciri E2:
- Reaksi ini berlangsung dalam satu tahap, tanpa pembentukan intermediet karbokation.
- Laju reaksi bergantung pada konsentrasi basa dan substrat. Oleh karena itu, reaksi E2 adalah orde kedua.
- E2 sering terjadi dengan basa kuat, seperti ion hidroksida (OH⁻) atau etoksida (CH₃CH₂O⁻).
- Reaksi E2 menghasilkan ikatan rangkap dua antara dua atom karbon yang awalnya mengikat hidrogen dan halogen.
Contoh Reaksi E2: Dehidrohalogenasi bromoetana dengan basa kuat (NaOH) menghasilkan etena:
CH3CH2Br+NaOH→CH2=CH2+NaBr+H2O
2. Reaksi Eliminasi E1 (Eliminasi Unimolekuler)
Reaksi eliminasi E1 (eliminasi unimolekuler) adalah reaksi dua tahap, di mana tahap pertama adalah pelepasan gugus lepas (seperti halida), yang menghasilkan pembentukan intermediet karbokation. Tahap kedua adalah penghilangan proton (H⁺) dari atom karbon yang berdekatan, menghasilkan pembentukan ikatan rangkap dua.
Ciri-ciri E1:
- Reaksi E1 berlangsung dalam dua tahap. Tahap pertama melibatkan pembentukan karbokation, dan tahap kedua adalah abstraksi proton oleh basa.
- Laju reaksi bergantung hanya pada konsentrasi substrat, sehingga E1 adalah reaksi orde pertama.
- Reaksi E1 lebih sering terjadi pada substrat yang dapat membentuk karbokation stabil, seperti halida alkil tersier.
- Reaksi ini biasanya berlangsung dalam pelarut polar protik (seperti air atau alkohol), yang menstabilkan karbokation.
Contoh Reaksi E1: Dehidrasi alkohol tersier (misalnya, 2-metil-2-propanol) di bawah kondisi asam menghasilkan 2-metilpropena melalui pembentukan karbokation.
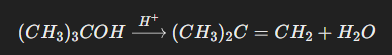
3. Reaksi Eliminasi E1cB (Eliminasi melalui Karbanion)
Reaksi eliminasi E1cB (eliminasi unimolekuler conjugate base) terjadi melalui pembentukan intermediet karbanion, bukan karbokation. Reaksi ini sering terjadi ketika substrat memiliki gugus lepas yang buruk dan basa yang kuat digunakan. Dalam mekanisme ini, proton pertama kali dihilangkan, membentuk intermediet karbanion, kemudian diikuti oleh pelepasan gugus lepas.
Ciri-ciri E1cB:
- Tahap pembentukan karbanion mendahului pelepasan gugus lepas.
- Biasanya terjadi dengan basa kuat dan ketika substrat mengandung gugus yang cenderung buruk sebagai gugus lepas.
- Substrat yang cocok untuk reaksi ini sering memiliki gugus penarik elektron yang stabilisasi karbanion, seperti gugus karbonil atau nitro.
Contoh Reaksi E1cB: Eliminasi dari β-keto ester yang menghasilkan senyawa alkena melalui pembentukan intermediet karbanion.
Faktor-faktor yang Mempengaruhi Reaksi Eliminasi
Ada beberapa faktor yang mempengaruhi jalannya reaksi eliminasi, termasuk kekuatan basa, sifat substrat, dan suhu. Pemahaman tentang faktor-faktor ini membantu dalam menentukan apakah reaksi akan mengikuti mekanisme E1, E2, atau E1cB.
- Kekuatan Basa:
- Reaksi E2 umumnya membutuhkan basa kuat untuk menarik proton dari substrat.
- Pada reaksi E1, basa tidak diperlukan dalam jumlah besar karena tahap pertama melibatkan pembentukan karbokation, yang diikuti oleh pelepasan proton secara spontan.
- Basa kuat juga dibutuhkan untuk E1cB karena proton yang dihilangkan harus distabilkan oleh basa.
- Sifat Substrat:
- Substrat tersier lebih cenderung mengalami reaksi E1 karena dapat membentuk karbokation yang stabil.
- Substrat primer lebih cenderung menjalani reaksi E2 karena karbokation yang dihasilkan dalam reaksi E1 tidak stabil.
- Substrat yang mengandung gugus penarik elektron dapat mendukung pembentukan intermediet karbanion, sehingga lebih cocok untuk reaksi E1cB.
- Suhu:
- Reaksi eliminasi umumnya lebih disukai pada suhu yang lebih tinggi. Dalam banyak kasus, peningkatan suhu akan meningkatkan laju eliminasi, terutama pada reaksi E2.
- Pelarut:
- Reaksi E1 lebih sering terjadi dalam pelarut polar protik, seperti air atau alkohol, yang dapat menstabilkan karbokation.
- E2 lebih mungkin terjadi dalam pelarut aprotik seperti dimetil sulfoksida (DMSO), yang tidak melibatkan proton untuk menstabilkan intermediet.
Contoh dan Aplikasi Reaksi Eliminasi
Reaksi eliminasi memiliki banyak aplikasi dalam kimia organik, terutama dalam sintesis senyawa tak jenuh yang lebih reaktif, seperti alkena dan alkuna. Beberapa contoh penting dari aplikasi reaksi eliminasi meliputi:
- Sintesis Alkena: Reaksi eliminasi, seperti dehidrohalogenasi, banyak digunakan dalam sintesis alkena, yang merupakan senyawa tak jenuh penting dalam berbagai reaksi kimia organik, termasuk polimerisasi.
- Sintesis Alkil Halida: Eliminasi dehidrasi dari alkohol menggunakan asam kuat sering digunakan dalam industri kimia untuk memproduksi senyawa alkena, yang kemudian dapat digunakan untuk membuat senyawa lain seperti plastik dan bahan bakar.
- Pembuatan Bahan Kimia Industri: Banyak bahan kimia yang diproduksi melalui proses eliminasi. Misalnya, reaksi eliminasi dari hidrokarbon aromatik dapat menghasilkan bahan baku penting untuk industri farmasi dan plastik.
Kesimpulan
Reaksi eliminasi adalah proses penting dalam kimia organik, di mana dua substituen dihilangkan dari molekul untuk membentuk ikatan rangkap. Ada beberapa jenis reaksi eliminasi, termasuk mekanisme E1, E2, dan E1cB, yang masing-masing memiliki karakteristik dan kondisi reaksi yang berbeda. Reaksi eliminasi tidak hanya relevan dalam konteks teoritis, tetapi juga memainkan peran penting dalam berbagai aplikasi industri dan sintesis senyawa organik. Pemahaman yang baik tentang mekanisme, faktor-faktor yang mempengaruhi reaksi, dan aplikasinya membantu para kimiawan merancang proses sintesis yang efisien dan menghasilkan senyawa yang diinginkan.