Alkana adalah salah satu kelas senyawa organik yang paling sederhana dan paling umum, terdiri dari atom karbon dan hidrogen dengan ikatan tunggal di antara atom-atom karbon. Struktur alkana memainkan peran penting dalam kimia organik, karena senyawa ini merupakan blok bangunan dasar untuk senyawa yang lebih kompleks. Dalam artikel ini, kita akan membahas struktur alkana, sifat-sifatnya, serta pentingnya dalam berbagai aplikasi.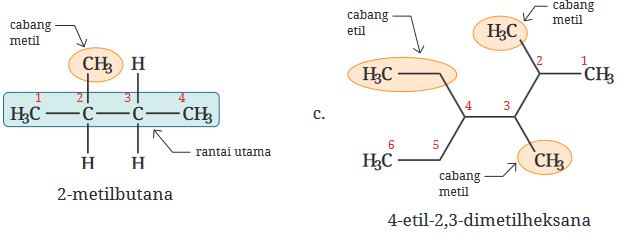
1. Konsep Dasar Alkana
Alkana, juga dikenal sebagai parafin, adalah hidrokarbon jenuh yang memiliki rumus umum CnH2n+2, di mana n adalah jumlah atom karbon dalam molekul. Senyawa ini dapat berupa rantai lurus (linear) atau bercabang. Contoh alkana yang paling sederhana adalah metana (CH₄), etana (C₂H₆), propana (C₃H₈), dan butana (C₄H₁₀). Semakin banyak atom karbon dalam rantai, semakin kompleks struktur dan sifat fisiknya.
Rantai karbon dalam alkana dapat terdiri dari beberapa atom yang terhubung satu sama lain dengan ikatan tunggal (sigma, σ). Setiap atom karbon dalam rantai memiliki empat ikatan, mengikuti aturan oktet, yang berarti bahwa ia cenderung terikat dengan atom hidrogen atau atom karbon lainnya untuk memenuhi kebutuhan ikatan tersebut. Ini memberikan alkana sifat-sifat tertentu yang membedakannya dari jenis hidrokarbon lainnya, seperti alkena dan alkuna, yang memiliki ikatan ganda atau triple.
2. Struktur dan Isomerisme Alkana
Salah satu aspek menarik dari alkana adalah isomerisme, yaitu fenomena di mana senyawa dengan rumus molekul yang sama memiliki struktur yang berbeda. Isomerisme dapat terjadi dalam dua bentuk: isomer struktural dan isomer stereoisomer. Isomer struktural terjadi ketika atom-atom dalam senyawa diatur dalam urutan yang berbeda, sedangkan stereoisomer berkaitan dengan konfigurasi spasial dari atom-atom tersebut.
Sebagai contoh, butana (C₄H₁₀) memiliki dua isomer struktural: n-butana, yang merupakan rantai lurus, dan isobutana, yang memiliki struktur bercabang. Isomer ini memiliki sifat fisik dan kimia yang berbeda meskipun memiliki rumus molekul yang sama. Isomerisme ini penting dalam kimia organik karena dapat mempengaruhi reaktivitas dan sifat fisik senyawa.
3. Sifat Fisik dan Kimia Alkana
Alkana memiliki sifat fisik yang khas. Secara umum, alkana dengan rantai karbon yang lebih panjang memiliki titik didih dan titik leleh yang lebih tinggi. Ini disebabkan oleh peningkatan gaya London (gaya Van der Waals) yang terjadi akibat peningkatan ukuran molekul dan jumlah elektron. Sebagai contoh, metana memiliki titik didih yang sangat rendah (-161°C), sedangkan dekana (C₁₀H₂₂) memiliki titik didih sekitar 174°C.
Dari segi reaktivitas, alkana adalah senyawa yang relatif stabil. Mereka tidak bereaksi dengan asam atau basa, dan hanya bereaksi dalam kondisi tertentu, seperti pembakaran atau reaksi dengan klorin dalam proses halogenasi. Reaksi pembakaran menghasilkan energi dalam bentuk panas dan cahaya, yang menjadikan alkana sebagai sumber energi yang penting dalam kehidupan sehari-hari, terutama dalam bentuk gas alam dan bahan bakar kendaraan.
4. Pentingnya Alkana dalam Kehidupan Sehari-hari
Alkana memiliki berbagai aplikasi dalam kehidupan sehari-hari dan industri. Sebagai contoh, metana adalah komponen utama gas alam dan digunakan sebagai bahan bakar untuk pemanas, kompor, dan kendaraan. Etana, di sisi lain, digunakan sebagai bahan baku dalam produksi etilena, yang merupakan bahan dasar untuk berbagai plastik dan bahan kimia lainnya.
Selain itu, alkana juga digunakan dalam pembuatan pelarut, bahan bakar, dan produk-produk kimia lainnya. Dalam industri petrokimia, alkana diekstrak dari minyak bumi dan digunakan sebagai bahan baku dalam sintesis senyawa organik yang lebih kompleks. Dengan demikian, alkana bukan hanya merupakan senyawa sederhana, tetapi juga merupakan komponen penting dalam banyak proses industri dan produk yang kita gunakan sehari-hari.
Kesimpulan
Struktur alkana adalah landasan penting dalam memahami kimia organik dan sifat-sifat hidrokarbon jenuh. Dengan rumus umum CnH2n+2, alkana memiliki berbagai isomer dan sifat fisik yang unik. Meskipun merupakan senyawa yang relatif stabil, alkana memiliki peran yang signifikan dalam kehidupan sehari-hari, baik sebagai sumber energi maupun bahan baku untuk berbagai produk industri. Pemahaman yang mendalam tentang struktur dan sifat alkana membuka jalan bagi eksplorasi lebih lanjut dalam bidang kimia organik dan aplikasinya. Dalam banyak cara, alkana adalah jantung dari banyak proses kimia yang membentuk dunia di sekitar kita.
FAQ: Struktur Alkana
1. Apa itu alkana?
Alkana adalah senyawa hidrokarbon jenuh yang hanya mengandung ikatan tunggal antara atom karbon. Alkana memiliki rumus umum CnH2n+2, di mana n adalah jumlah atom karbon dalam molekul.
2. Apa ciri khas struktur alkana?
Struktur alkana dicirikan oleh rantai atom karbon yang terikat satu sama lain dengan ikatan tunggal (C−C) dan atom hidrogen yang terikat pada atom karbon. Karena hanya memiliki ikatan tunggal, alkana disebut “jenuh,” artinya setiap atom karbon telah mencapai jumlah maksimum ikatan dengan hidrogen.
3. Bagaimana alkana dinomori atau dinamai?
Alkana dinamai berdasarkan jumlah atom karbon dalam rantai utamanya:
- Metana (CH4) – 1 karbon
- Etana (C2H6) – 2 karbon
- Propana (C3H8) – 3 karbon
- Butana (C4H10) – 4 karbon
- Pentana (C5H12) – 5 karbon
- Dan seterusnya.
Untuk alkana bercabang, rantai karbon terpanjang diidentifikasi sebagai rantai utama, dan cabang-cabangnya dinamai sebagai substituen, diikuti dengan penomoran yang menunjukkan posisi cabang pada rantai utama.
4. Apa perbedaan antara alkana linear dan alkana bercabang?
- Alkana linear memiliki struktur di mana atom karbon tersusun dalam satu rantai panjang tanpa cabang.
- Alkana bercabang memiliki satu atau lebih cabang yang terikat pada rantai karbon utama. Cabang-cabang ini adalah kelompok alkil, yang diambil dari alkana dengan satu atom hidrogen lebih sedikit (misalnya, metil dari metana, etil dari etana).
5. Apa contoh dari alkana linear dan bercabang?
- Alkana linear: n-butana (C4H10) adalah alkana dengan empat atom karbon yang tersusun dalam satu rantai lurus.
- Alkana bercabang: isobutana (C4H10) adalah isomer dari n-butana, di mana satu atom karbon bercabang dari rantai utama.
6. Bagaimana isomerisme berperan dalam struktur alkana?
Alkana dapat memiliki isomer, yaitu senyawa yang memiliki rumus molekul sama tetapi struktur berbeda. Isomerisme struktur ini terjadi karena perbedaan dalam cara atom karbon diatur dalam rantai (misalnya, n-butana dan isobutana).
7. Bagaimana sifat fisik alkana dipengaruhi oleh strukturnya?
Sifat fisik seperti titik didih, titik leleh, dan kepadatan alkana dipengaruhi oleh panjang rantai karbon dan tingkat percabangan:
- Titik didih: Alkana dengan rantai karbon lebih panjang memiliki titik didih lebih tinggi karena kekuatan gaya dispersi London yang lebih besar. Alkana bercabang biasanya memiliki titik didih lebih rendah dibandingkan alkana linear dengan jumlah atom karbon yang sama karena bentuk bercabang mengurangi kontak antar molekul.
- Kepadatan: Alkana umumnya kurang padat daripada air, dan kepadatan meningkat dengan bertambahnya jumlah atom karbon.
8. Apakah alkana dapat bereaksi secara kimia?
Alkana dikenal cukup stabil dan kurang reaktif karena ikatan C−C dan C−H yang kuat. Namun, alkana dapat mengalami beberapa reaksi kimia seperti:
- Pembakaran: Alkana bereaksi dengan oksigen menghasilkan karbon dioksida dan air, biasanya dalam bentuk panas dan cahaya (reaksi eksotermik).
- Halogenasi: Alkana dapat bereaksi dengan halogen (seperti klorin atau bromin) di bawah kondisi tertentu, menghasilkan haloalkana.
9. Apa aplikasi dari alkana dalam kehidupan sehari-hari?
Alkana memiliki banyak aplikasi penting:
- Metana digunakan sebagai bahan bakar utama dalam gas alam.
- Propana dan butana digunakan dalam gas LPG (liquefied petroleum gas) untuk memasak dan pemanasan.
- Alkana yang lebih berat seperti oktana merupakan komponen utama dalam bensin.
- Parafin (campuran alkana dengan rantai panjang) digunakan dalam lilin, pelumas, dan sebagai bahan untuk pembungkus makanan.
10. Bagaimana cara menggambar atau mewakili struktur alkana?
Struktur alkana dapat digambarkan dengan berbagai cara:
- Rumus molekul menunjukkan jumlah atom karbon dan hidrogen (misalnya, C4H10 untuk butana).
- Rumus struktur lengkap menunjukkan semua ikatan antara atom karbon dan hidrogen.
- Rumus garis/kerangka hanya menunjukkan ikatan karbon-karbon dengan asumsi bahwa hidrogen terikat pada setiap karbon sesuai dengan jumlah yang diperlukan.