Termodinamika adalah cabang ilmu fisika yang mempelajari energi dan perpindahannya, khususnya yang berkaitan dengan panas dan kerja. Dalam sistem fisika, energi tidak bisa diciptakan atau dimusnahkan, tetapi bisa berubah bentuk dan berpindah antar sistem. Prinsip ini dijelaskan dalam empat hukum utama yang dikenal sebagai hukum-hukum termodinamika.
Hukum-hukum ini sangat penting dalam berbagai bidang, termasuk teknik mesin, kimia, biologi, hingga teknologi modern seperti pembangkit listrik dan pendingin udara. Berikut adalah penjelasan lengkap dari setiap hukum termodinamika beserta contohnya dalam kehidupan sehari-hari.
Hukum Termodinamika Nol
Hukum termodinamika nol menyatakan bahwa jika dua sistem berada dalam keseimbangan termal dengan sistem ketiga, maka kedua sistem tersebut juga berada dalam keseimbangan termal satu sama lain.
Secara sederhana, hukum ini menegaskan konsep suhu sebagai besaran yang menentukan keseimbangan termal. Jika dua benda memiliki suhu yang sama, maka tidak ada perpindahan panas di antara keduanya.
Contoh Hukum Termodinamika Nol
1. Termometer dalam Air Panas
Saat kita mencelupkan termometer ke dalam air panas, termometer akan menyerap atau melepaskan kalor hingga suhu air dan suhu termometer sama. Setelah keseimbangan tercapai, termometer menunjukkan suhu yang benar.
2. Pendingin Ruangan (AC)
Ketika AC bekerja dalam suatu ruangan, ia akan terus menyesuaikan suhu udara hingga ruangan mencapai suhu yang sama dengan yang telah diatur pada perangkat AC. Setelah suhu seimbang, AC akan berhenti mendinginkan sementara waktu.
Hukum Pertama Termodinamika
Hukum pertama termodinamika dikenal sebagai hukum kekekalan energi, yang menyatakan bahwa energi dalam suatu sistem tertutup tidak dapat diciptakan atau dimusnahkan, tetapi hanya dapat diubah bentuknya. Secara matematis, hukum ini dinyatakan sebagai:
![]()
Di mana:
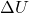 adalah perubahan energi dalam sistem
adalah perubahan energi dalam sistem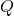 adalah kalor yang diberikan ke sistem
adalah kalor yang diberikan ke sistem adalah kerja yang dilakukan oleh sistem
adalah kerja yang dilakukan oleh sistem
Jika suatu sistem menerima kalor, energinya meningkat, tetapi jika sistem melakukan kerja, energinya berkurang.
Contoh Hukum Pertama Termodinamika
1. Mesin Uap
Dalam mesin uap, energi panas dari pembakaran bahan bakar mengubah air menjadi uap. Uap ini kemudian digunakan untuk menggerakkan piston, mengubah energi panas menjadi energi mekanik yang digunakan dalam berbagai mesin industri dan lokomotif.
2. Manusia Makan untuk Mendapatkan Energi
Ketika kita makan, makanan dikonversi menjadi energi dalam tubuh yang digunakan untuk beraktivitas. Energi kimia dalam makanan berubah menjadi energi kinetik (untuk bergerak) dan energi panas (untuk menjaga suhu tubuh).
Hukum Kedua Termodinamika
Hukum kedua termodinamika menyatakan bahwa entropi (tingkat ketidakteraturan) dalam sistem tertutup selalu meningkat seiring waktu. Ini berarti bahwa energi cenderung tersebar dan sistem akan bergerak menuju keadaan yang lebih tidak teratur.
Secara sederhana, hukum ini menyatakan bahwa kalor secara alami berpindah dari benda bersuhu tinggi ke benda bersuhu rendah, bukan sebaliknya, kecuali ada usaha eksternal yang dilakukan.
Contoh Hukum Kedua Termodinamika
1. Es Batu yang Mencair
Jika kita meletakkan es batu di dalam ruangan, es akan mencair karena kalor dari udara berpindah ke es, meningkatkan entropi sistem. Air yang mencair memiliki susunan molekul yang lebih acak dibandingkan dengan bentuk padatnya.
2. Pembangkit Listrik Tenaga Uap
Dalam pembangkit listrik tenaga uap, energi panas dari pembakaran bahan bakar menggerakkan turbin untuk menghasilkan listrik. Namun, sebagian energi panas akan hilang ke lingkungan dalam bentuk limbah panas, yang tidak dapat sepenuhnya dikonversi menjadi kerja. Ini menunjukkan bahwa tidak ada mesin yang 100% efisien karena selalu ada energi yang terbuang.
Hukum Ketiga Termodinamika
Hukum ketiga termodinamika menyatakan bahwa saat suhu suatu sistem mendekati nol absolut (![]() atau 0 Kelvin), entropi sistem akan mendekati nol, dan seluruh gerakan molekuler akan berhenti. Ini berarti bahwa pada suhu nol absolut, suatu benda berada dalam keadaan yang paling teratur dan tidak memiliki energi termal.
atau 0 Kelvin), entropi sistem akan mendekati nol, dan seluruh gerakan molekuler akan berhenti. Ini berarti bahwa pada suhu nol absolut, suatu benda berada dalam keadaan yang paling teratur dan tidak memiliki energi termal.
Namun, dalam kenyataannya, mencapai nol absolut tidak mungkin karena selalu ada sedikit energi yang tersisa dalam sistem.
Contoh Hukum Ketiga Termodinamika
1. Superkonduktor pada Suhu Rendah
Pada suhu mendekati nol absolut, beberapa material berubah menjadi superkonduktor, yang berarti mereka dapat menghantarkan listrik tanpa hambatan. Ini digunakan dalam teknologi seperti MRI (Magnetic Resonance Imaging) dan akselerator partikel.
2. Gas yang Mendingin dalam Ruang Hampa
Ketika gas didinginkan hingga suhu yang sangat rendah, gerakan molekulnya melambat drastis. Jika mendekati nol absolut, molekul akan hampir sepenuhnya diam, tetapi tetap mustahil untuk mencapai keadaan tanpa energi sama sekali.
Kesimpulan
Hukum-hukum termodinamika merupakan prinsip dasar yang mengatur energi dan perpindahannya dalam berbagai sistem fisik.
- Hukum Nol menjelaskan keseimbangan termal dan suhu.
- Hukum Pertama menyatakan bahwa energi tidak dapat diciptakan atau dimusnahkan, hanya bisa berubah bentuk.
- Hukum Kedua menunjukkan bahwa entropi dalam sistem selalu meningkat, dan energi selalu cenderung menyebar.
- Hukum Ketiga menyatakan bahwa pada nol absolut, entropi mencapai titik minimum, tetapi keadaan ini tidak bisa benar-benar dicapai.
Pemahaman tentang hukum-hukum ini sangat penting dalam bidang teknik, fisika, kimia, dan berbagai aplikasi teknologi seperti pembangkit listrik, pendinginan, dan transportasi energi. Tanpa hukum-hukum ini, banyak aspek kehidupan modern, seperti mesin, pendingin udara, hingga pemrosesan makanan, tidak dapat dijelaskan atau dikembangkan secara efisien.